mai 16, 2023
A Philips fornece informações actualizadas sobre o conjunto completo de resultados dos testes para dispositivos de terapia do sono CPAP/BiPAP
Amesterdão, Países Baixos – A Royal Philips (NYSE: PHG; AEX: PHIA), fornece hoje uma atualização sobre o programa compreensivo de testes e investigação da sua subsidiária Philips Respironics para avaliar os potenciais riscos para a saúde relacionados com a espuma de redução de som de poliuretano à base de poliéster (PE-PUR) em dispositivos de terapia do sono e ventiladores específicos ao abrigo da notificação de recolha voluntária/aviso de segurança de junho de 2021*.
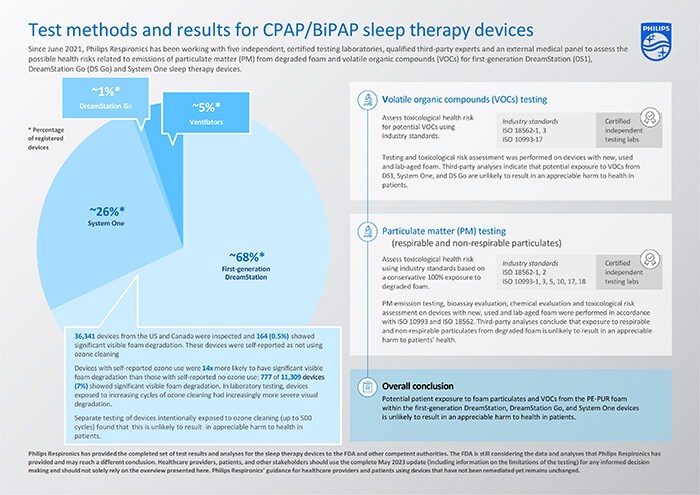
As avaliações de risco foram agora concluídas para os dispositivos de terapia do sono CPAP/BiPAP ao abrigo do aviso de segurança*, isto é, os dispositivos DreamStation, System One e DreamStation Go de primeira geração, que representam aproximadamente 95% dos dispositivos registados a nível mundial. As avaliações baseiam-se nas atualizações anteriores a dezembro de 2021, junho de 2022 e dezembro de 2022. Adicionalmente, foram concluídos testes e análises para dispositivos de primeira geração DreamStation que foram expostos a limpeza com ozono.
Métodos de Teste
O programa de testes e investigação foi realizado em conjunto com cinco laboratórios de testes independentes e certificados, sendo que os resultados foram revistos e avaliados por peritos qualificados de terceiros e pela Philips Respironics, bem como por um painel médico externo.
Os métodos de teste aplicados - incluindo o planeamento do teste, a execução do teste e a interpretação dos resultados para as avaliações de risco concluídas - estão em conformidade com as normas industriais aplicáveis ISO 18562 [1,2] e ISO 10993 [3]. A concepção dos métodos de ensaio aplicados foi ainda cientificamente sustentada através de considerações e mitigações exaustivas das limitações inerentes aos ensaios. Por exemplo, os testes foram efectuados em vários dispositivos usados, com quantidades variáveis de utilização pelos doentes, onde foi observada degradação visual da espuma, e em espuma envelhecida em laboratório que foi intencionalmente degradada em diferentes graus. Foram incluídos pressupostos muito conservadores nas avaliações de risco. No final deste comunicado de imprensa, são ainda apresentados outros exemplos.
"A nossa primeira prioridade é a saúde e o bem-estar dos doentes", afirmou Roy Jakobs, CEO da Royal Philips. "Por isso, concentrámo-nos no programa abrangente de testes e investigação para obter maior clareza sobre a segurança dos dispositivos afectados, e no fornecimento de dispositivos de substituição aos doentes. As avaliações de risco, por terceiros, para os dispositivos de terapia do sono apresentadas hoje, são positivas e tranquilizadoras, e estamos a fazer bons progressos na remediação dos dispositivos afectados. As autoridades competentes relevantes a nível mundial, incluindo a FDA, estão ainda a analisar os resultados dos testes e avaliações. Partilhamos o mesmo objectivo de garantir a segurança e a qualidade dos pacientes na prestação de cuidados de saúde, e continuamos empenhados em trabalhar em estreita colaboração com estas agências. A conclusão dos testes e a remediação dos dispositivos afetados continuam a ser as nossas prioridades principais."
Resultados de ensaios e análises de dispositivos de terapia do sono não expostos à limpeza com ozono
O conjunto completo de resultados de testes e análises para os dispositivos de terapia do sono DreamStation, System One e DreamStation Go de primeira geração indica que a potencial exposição do paciente a partículas de espuma (PM) e compostos orgânicos voláteis (VOCs) da espuma de PE-PUR que está dentro desses dispositivos é improvável de resultar em danos apreciáveis à saúde dos pacientes. Os testes efectuados e as conclusões foram resumidos no quadro seguinte.
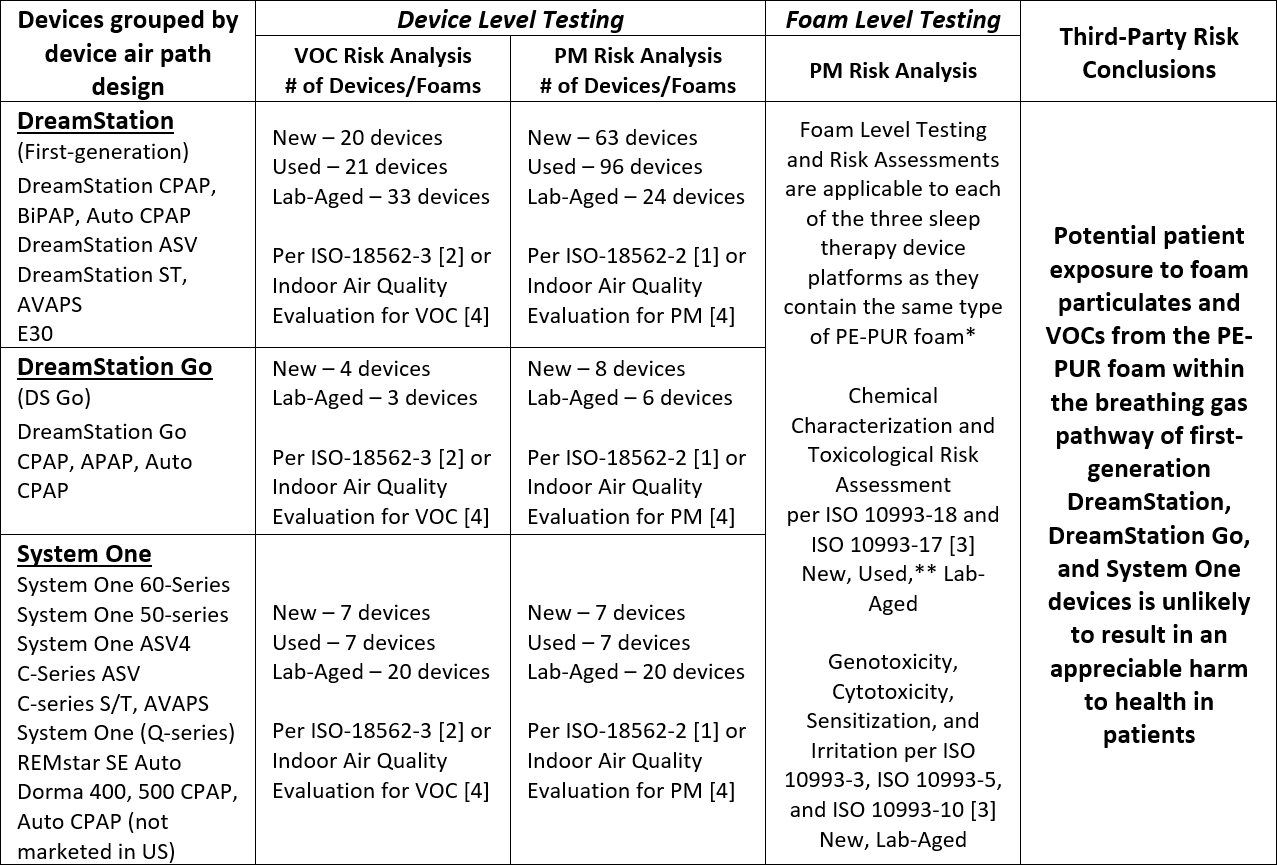
VOC: Volatile Organic Compound
PM: Particulate Matter
* The total amount of foam in the devices varies from approximately 1 g to 10 g, depending on the device airpath design and configuration. Devices within each platform share the same airpath design and configuration, including the amount of foam present.
** The foam from 7 different Used first-generation DreamStation devices was chemically characterized per ISO 10993-18 and -17 [3] and included foam representative of a range of visual degradation states.
Os testes alargados e as avaliações de risco toxicológico em vários dispositivos com espuma nova, usada e envelhecida em laboratório não revelaram qualquer dano apreciável para a saúde relativamente aos VOCs detectados com base nos testes ISO 18562-3 [2], e uma avaliação de risco efectuada por terceiros concluiu que é improvável que a exposição aos VOCs destes dispositivos resulte num dano apreciável para a saúde dos pacientes.
Foram testados dispositivos novos, envelhecidos em laboratório e usados e todos estavam em conformidade com os limites permitidos pela norma ISO 18562-2 [1] para as emissões de partículas. Os testes foram realizados em dispositivos usados (isto é, dispositivos anteriormente utilizados por pacientes) com diferentes graus de degradação (isto é, desde a ausência de degradação visível até à degradação visível grave), dispositivos novos e dispositivos com espuma envelhecida em laboratório que tinham sido intencionalmente expostos a temperaturas significativamente elevadas (≥80°C) e humidade (≥75% HR) para acelerar a degradação.
Adicionamente, as emissões de partículas testadas em dispositivos usados com degradação visível não foram estatisticamente diferentes das emissões de partículas em dispositivos usados sem degradação, sugerindo que a degradação não contribuiu para níveis elevados apreciáveis de partículas respiráveis nos dispositivos testados.
Mesmo com o pressuposto muito conservador e teórico de que toda a espuma se poderia degradar e de que um doente seria então exposto a toda a espuma PE-PUR degradada dentro dos dispositivos, a avaliação de riscos efectuada por terceiros concluiu que a exposição a partículas de espuma degradada nestes dispositivos, incluindo potenciais partículas respiráveis e não respiráveis, não é susceptível de resultar num dano apreciável para a saúde dos doentes.
Com base na inspecção visual da espuma nos dispositivos DreamStation de primeira geração devolvidos, a prevalência de degradação visível da espuma foi considerada baixa. A inspecção visual só pode identificar a degradação visível da espuma e não pode medir a produção de compostos orgânicos voláteis, nem quantificar a perda de partículas, pelo que foram realizados testes e análises adicionais, conforme descrito acima e na actualização completa.
O impacto da limpeza com ozono na degradação da espuma dos dispositivos DreamStation de primeira geração
A Philips Respironics concluiu os testes dos dispositivos DreamStation de primeira geração que foram expostos a limpeza com ozono:
Os testes de VOC da norma ISO 18562-3 mostraram que, após 200 ciclos de limpeza com ozono - cada ciclo simulando uma noite de utilização, seguida da limpeza com ozono - o dietilenoglicol (DEG) tornou-se detectável como um VOC. Os testes foram realizados até 500 ciclos de limpeza com ozono, e um risco toxicológico de VOC desta degradação induzida pelo ozono determinou que a exposição às emissões de VOC dos dispositivos DreamStation de primeira geração avaliados expostos à limpeza com ozono não sugere qualquer risco apreciável para a saúde dos pacientes.
No que diz respeito aos riscos associados às partículas respiráveis e não respiráveis, os testes até à data foram realizados em dispositivos com exposição conhecida ao ozono. Por exemplo, dois dispositivos DreamStation de primeira geração usados com exposição ao ozono comunicada pelo utilizador foram incluídos em testes de extraíveis e lixiviáveis, que formaram a base para uma avaliação de risco toxicológico das partículas de espuma PE-PUR do dispositivo de terapia do sono. Essa análise colectiva de terceiros concluiu que é improvável que a exposição a partículas de espuma degradada nos dispositivos DreamStation de primeira geração resulte num dano apreciável para a saúde dos pacientes.
Tal como publicado anteriormente, os dados relativos à primeira geração da DreamStation indicam que os dispositivos com limpeza com ozono comunicada pelo utilizador têm 14 vezes mais probabilidades de apresentar degradação/ redução significativa do volume da espuma visível em comparação com os dispositivos sem exposição ao ozono comunicada pelo utilizador. Esta observação é consistente com os testes laboratoriais, nos quais os dispositivos DreamStation de primeira geração expostos a ciclos crescentes de limpeza com ozono apresentavam uma degradação visual cada vez mais grave. No entanto, como se concluiu anteriormente, é pouco provável que tal resulte num dano apreciável para a saúde dos pacientes.
Resumo dos testes em curso
A Philips Respironics está ainda em processo de conclusão de vários testes e análises. As avaliações de risco dos dispositivos System One e DreamStation Go (que contêm a mesma espuma que os dispositivos DreamStation de primeira geração) tratados com limpeza por ozono estão a ser concluídas. Para os dispositivos de ventilação Trilogy 100/200 e OmniLab Advanced Plus, continuam a ser executados os testes de VOC e PM, bem como a avaliação química e a avaliação dos riscos toxicológicos. Estes dispositivos contêm um tipo diferente de espuma PE-PUR do que os dispositivos DreamStation de primeira geração [5]. A Philips Respironics espera fornecer uma actualização sobre este assunto no terceiro trimestre de 2023
Orientações para prestadores de cuidados de saúde e pacientes
Os pacientes que utilizam actualmente um dispositivo de terapia do sono afectado que não tenha sido corrigido e que ainda não tenha sido registado, devem registar os seus dispositivos para facilitar a sua remediação.
A Philips Respironics continua a aconselhar os pacientes que utilizam dispositivos de terapia do sono afectados que ainda não foram corrigidos a contactar o seu médico ou prestador de cuidados de saúde para fazer uma decisão sobre o tratamento adequado para a sua condição, que pode incluir a interrupção da utilização do dispositivo, a continuação da utilização do dispositivo afectado, a utilização de outro dispositivo semelhante que não faça parte da recolha, ou a utilização de tratamentos alternativos para a apneia do sono. Além disso, os doentes são aconselhados a seguir as instruções da Philips Respironics e as directrizes de limpeza e substituição recomendadas para o seu dispositivo de terapia do sono e acessórios. Os produtos de limpeza com ozono e luz UV não são métodos de limpeza actualmente aprovados para dispositivos ou máscaras de terapia do sono e não devem ser utilizados.
A Philips Respironics também continua a aconselhar os utilizadores de dispositivos de ventilação a contactarem os seus prestadores de cuidados de saúde antes de fazerem quaisquer alterações à sua terapia.
Fundamentação científica dos métodos de teste
A concepção dos métodos de teste aplicados foi cientificamente sustentada com base em ponderações e atenuações exaustivas das limitações dos ensaios que são inerentes a qualquer norma de teste e/ou investigação científica. Para ilustrar este facto, são enumerados em seguida exemplos de tais ponderações e atenuações.
A fundamentação científica dos métodos de teste aplicados incluiu ponderações e atenuações exaustivas das limitações dos ensaios, como por exemplo:
Notes * Voluntary recall notification in the US/field safety notice for the rest of the world. [1] ISO 18562-2: Biocompatibility evaluation of breathing gas pathways in healthcare applications – Part 2: Tests for emissions of particulate matter. [2] ISO 18562-3: Biocompatibility evaluation of breathing gas pathways in healthcare applications – Part 3: Tests for emissions of volatile organic compounds. [3] ISO 10993: Biological evaluation of medical devices; Part 1: Evaluation and testing within a risk management process; Part 3: Tests for genotoxicity, carcinogenicity and reproductive toxicity; Part 5: Tests for in vitro cytotoxicity; Part 10: Tests for irritation and skin sensitization; Part 17: Establishment of allowable limits for leachable substances; Part 18: Chemical characterization of medical device materials within a risk management process. [4] The standard that was used for tests prior to ISO 18562. [5] First-generation DreamStation, System One and DreamStation Go devices contain Type A PE-PUR foam, while Trilogy 100/200 devices contain Type B PE-PUR foam, and OmniLab Advanced Plus devices contain Type A and Type B PE-PUR foams. The known differences between the Type A and Type B foams are that Type B foam can be used with an acrylic pressure sensitive adhesive, has a lower density, has a different thickness, and also contains an additive to reduce potential flammability.
Sobre a Royal Philips
A Royal Philips (NYSE: PHG, AEX: PHI) é uma empresa líder em tecnologias de saúde que se dedica a melhorar a vida das pessoas e o seu bem-estar através de inovação significativa. A inovação da Philips centrada no paciente e nas pessoas utiliza tecnologia avançada e percepções clínicas e de consumo profundas para oferecer soluções de saúde pessoal para consumidores e soluções de saúde profissional para profissionais de saúde e os seus pacientes no hospital e em casa. Com sede na Holanda, a empresa é líder em diagnóstico por imagem, ultrassom, terapia guiada por imagem, monitorização e informática empresarial, bem como em saúde pessoal. A Philips gerou vendas de 17,8 bilhões de euros em 2022 e emprega aproximadamente 74.000 funcionários com vendas e serviços em mais de 100 países. Notícias sobre a Philips podem ser encontradas em www.philips.com/newscenter.
Forward-looking statements
This statement contains certain forward-looking statements with respect to the financial condition, results of operations and business of Philips and certain of the plans and objectives of Philips with respect to these items. Examples of forward-looking statements include statements made about the strategy, estimates of sales growth, future EBITA, future developments in Philips’ organic business and the completion of acquisitions and divestments. By their nature, these statements involve risk and uncertainty because they relate to future events and circumstances and there are many factors that could cause actual results and developments to differ materially from those expressed or implied by these statements.
Temas
Contactos

Steve Klink
Philips Global Press Office Tel: +31 6 10888824
You are about to visit a Philips global content page
Continue
César García Requena
Brand & Communications Manager Health System Philips Ibérica Tel : +34 91 566 95 25
You are about to visit a Philips global content page
ContinueMaterial gráfico