Aviso de segurança de dispositivo médico
Dispositivos de cuidados respiratórios e do sono Philips Respironics
FSN 2021-05-A & FSN 2021-06-A
Em outubro de 2023, a Philips Respironics iniciou a reparação de dispositivos Trilogy 100/200 através de centros de reparação aprovados pela Philips em vários países.
Os clientes continuam a ter a escolha entre a reparação dos seus dispositivos, compensação financeira, na forma de crédito de vendas em função dos dispositivos, actualização para o Trilogy Evo e um programa de empréstimo do Trilogy Evo. Nosso objetivo é em parceria com os clientes, concluir a ação corretiva o mais rápido possível para atender os pacientes nos dispositivos Trilogy 100/200 afetados.
Entre em contato com o seu gestor de conta da Philips Respironics se tiver dúvidas adicionais.
Abaixo está uma atualização sobre o status de nosso programa de reparação e substituição para dispositivos CPAP, BiPAP e ventiladores mecânicos afetados em 31 de outubro de 2024. Além do número de dispositivos de substituição entregues, também fornecemos uma visão geral do número de dispositivos que serão compensados financeiramente e o número de dispositivos que não foram rastreados pelos prestadores de cuidados domiciliários.
1,037,268
Número de kits de reparação e dispositivos de substituição produzidos para a Europa Ocidental
40,112
Número de dispositivos corrigidos enviados para clientes em Portugal
16,030
Compensação financeira1 de equipamentos aos prestadores de cuidados domiciliares
830
Dispositivos não rastreáveis2
1. Vários dispositivos de apneia do sono System One mais antigos encontram-se descontinuados pela Philips. Em muitos casos, esses dispositivos têm mais de cinco anos. Em consulta com os prestadores de cuidados domiciliários, a Philips chegou a um acordo sobre uma solução para esses pacientes. Para parte dos equipamentos usados, os prestadores de cuidados domiciliários recebem euipamentos alternativos ou reparados. Além disso, a Philips oferece uma compensação financeira para alguns desses dispositivos System One, para que os provedores de cuidados domiciliários possam comprar outro dispositivo para o paciente.
2. Os prestadores de cuidados domiciliários registaram uma série de dispositivos que já não estão em uso ou não podem ser rastreados. Os prestadores de cuidados domiciliários fizeram esforços para rastrear todos os dispositivos e pacientes. Assumimos que os dispositivos que não são mais rastreáveis não estão mais em uso.
You are about to visit a Philips global content page
Continue
Informações para pacientes
A segurança do paciente é nossa principal prioridade. Estamos empenhados em concluir a remediação de todos os pacientes afetados para garantir que recebe uma terapia segura e eficaz. Sabemos que cada situação é única, dependendo do dispositivo afetado e da situação pessoal. Se tiver dúvidas sobre o processo de correção ou precisar de qualquer suporte adicional depois de receber o dispositivo de substituição, entre em contato com seu prestador de cuidados domiciliários ou com o seu médico.

Criámos um guia que descreve cada passo do processo de reparação, para que possa compreender como estamos a lidar com o aviso de segurança e o que esperar.
Ultimas atualizações
Philips fornece atualização sobre a nota de segurança da Philips Respironics
06 de outubro de 2023
Resposta da Philips a artigos recentes na imprensa relacionados com a nota de segurança da Philips Respironics
27 de setembro de 2023
As conclusões dos resultados obtidos em julho de 2023 para dispositivos de terapia do sono relacionados ao impacto da limpeza com ozono não mostram danos apreciáveis à saúde dos pacientes
A Philips Respironics concluiu as análises dos dispositivos de terapia do sono System One e DreamStation Go, indicando que as emissões de compostos orgânicos voláteis (VOCs) e de material particulado (PM) relacionadas à degradação da espuma estão dentro dos limites de segurança aplicáveis. Avaliações visuais adicionais foram realizadas e confirmam a baixa prevalência de degradação significativa da espuma.
You are about to visit a Philips global content page
Continue
Compreender as medidas que tomamos para garantir a segurança do seu dispositivo de substituição CPAP ou BiPAP
Embora trabalhemos para fornecer dispositivos de substituição o mais rápido possível, queremos partilhar as medidas que estamos a tomar para garantir que seu dispositivo de substituição DreamStation de primeira geração é seguro para utilização, para que possa confiar no seu novo dispositivo.

Os produtos de limpeza com ozono e de luz ultravioleta não são métodos de limpeza atualmente aprovados para os dispositivos ou máscaras de apneia do sono e não devem ser utilizados.
Apoio em cada passo do caminho

Saiba mais sobre o aviso de segurança e registe o respetivo dispositivo afetado

Verifique as medidas que a Philips está a tomar para garantir a segurança e a confiança
Atualização para pacientes acerca da nota de segurança de dispositivo médico

Saiba mais sobre o seu dispositivo de substituição
Perguntas e respostas
Os seguintes produtos listados são afetados pela notificação de recolha/aviso de segurança:
Dispositivos CPAP e BiLevel PAP
Todos os dispositivos afetados fabricados antes de 26 de abril de 2021, todos os números de série dos dispositivos
Ventilador contínuo, suporte ventilatório mínimo, utilização em instalações
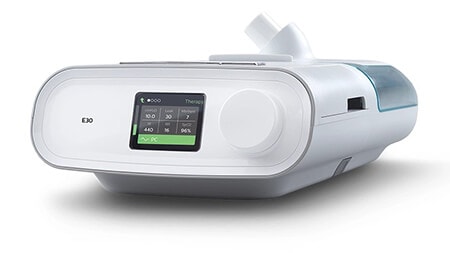
E30
(Autorização de utilização de emergência)

DreamStation ASV
Também conhecido comoDreamStation BiPAP autoSV

DreamStation ST, AVAPS
Também conhecido como DreamStation BiPAP AVAPS, DreamStation BiPAP S/T

SystemOne ASV4
Também conhecido como System One BiPAP autoSV, System One BiPAP autoSV Advanced

C Series S/T, AVAPS
Também conhecido como System One BiPAP AVAPS (C-Series), System One BiPAP S/T (C-Series)

OmniLab Advanced Plus
Dispositivo de titulação no laboratório
Ventilador contínuo, suporte ventilatório mínimo, utilização em instalações

A-Series BiPAP Hybrid A30
Também conhecido como BiPAP Hybrid A30Ventilator(A-Series)
(não comercializado nos EUA)

Ventilador A-Series BiPAP V30 Auto
Também conhecido como BiPAP V30 Auto Ventilator (A-Series)
Ventilador contínuo, não de suporte de vida

A-Series BiPAP A40
Também conhecida comoBiPAP A40 Ventilator (A-Series)
(não comercializado nos EUA)

A-Series BiPAP A30
Também conhecida comoBiPAP A30 Ventilator (A-Series)
(não comercializada nos EUA)
Se o seu dispositivo é afetado...
Que produtos não são afetados e porquê?
Os produtos que não são afetados podem ter materiais de espuma de atenuação do som diferentes, uma vez que novos materiais e tecnologias ficaram disponíveis ao longo do tempo. Além disso, a espuma de atenuação do som em dispositivos não afetados pode estar colocada num local diferente devido ao design do dispositivo.